



近日,国家纳米科学中心梁兴杰研究员与广州医科大学郭伟圣教授、天津大学常津教授课题组合作,在探索纳米化疗新策略克服肿瘤顺铂耐药方面取得进展,相关研究成果“Exploiting the acquired vulnerability of cisplatin-resistant tumors with a hypoxia-amplifying DNA repair-inhibiting (HYDRI) nanomedicine”发表于Science Advances。
金属铂类药物广泛应用于多种实体肿瘤的临床治疗,但随着化疗的进行,往往都不可避免的出现由肿瘤细胞DNA修复引起的顺铂化疗耐药问题。虽然将DNA修复抑制性药物与顺铂联合使用可取得一定的协同增强的效果,但是肿瘤细胞又将不可避免的对于DNA修复抑制性药物产生新的药物抗性,同时还会演变出新的顺铂耐药机制。因此,从发掘并利用耐药性肿瘤细胞的后天弱点的角度出发,可望为探索克服肿瘤耐药新方法提供启发。
在本研究工作中,研究人员通过模拟临床肿瘤产生顺铂耐药的发生过程,构建和筛选了多个顺铂耐药性的肿瘤细胞系,发现肿瘤细胞的顺铂耐药性是以细胞内缺氧加重为代价的。基于这一耐药相关性生理特征,研究团队提出了一个富有启发性的纳米药物化疗新策略,即利用肿瘤产生耐药性时出现的胞内乏氧来对抗肿瘤耐药性。研究团队构建了一种负载葡萄糖氧化酶、乏氧激活药物替拉扎明(TPZ)和金属铂前药的脂质体纳米药物(HYDRI NM)。该纳米药物不仅利用还主动加重顺铂耐药肿瘤胞内乏氧特征,从而有效激活TPZ药物活性。激活的TPZ不仅表现出较强的抗肿瘤活性,还可有效抑制肿瘤细胞内促DNA修复的F组着色性干皮病偶联因子(XPF)蛋白,从而和铂前药实现协同增强的抗肿瘤效果。在临床相关模型的研究中,包括患者源性类器官和患者源性异种移植瘤,该纳米化疗策略均可有效抑制顺铂耐药肿瘤的生长和转移,并具有良好的生物安全性和较低的毒副作用。本研究可望为临床探究克服肿瘤顺铂耐药提供新的思路和重要科学参考。
该项工作得到了国家自然科学基金重点项目、国家自然科学基金中德国际合作项目、国家自然科学基金面上项目等多个项目的支持。
原文链接:https://advances.sciencemag.org/content/7/13/eabc5267。
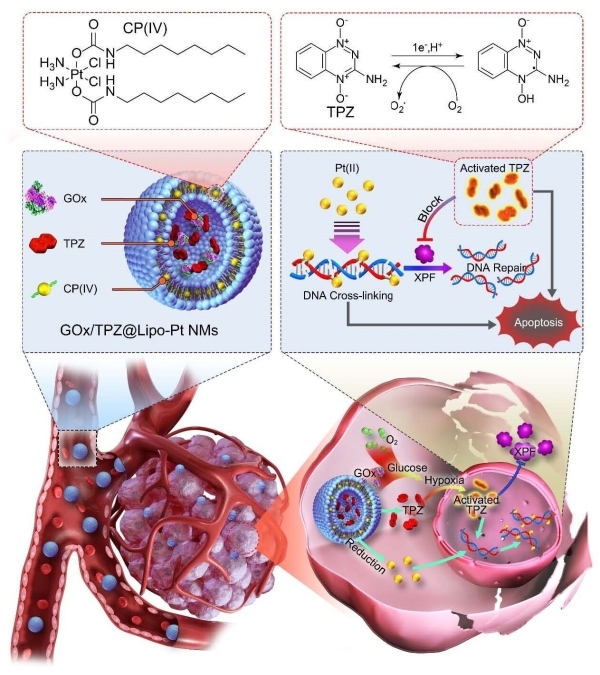
图:HYDRI纳米药物的结构示意图及其逆转肿瘤顺铂耐药的治疗