疫苗(抗原和佐剂)向淋巴结的高效共递送,激活体液免疫和细胞免疫应答,对于增强疫苗保护效力和更好避免免疫耐受至关重要。除了优化抗原外,在重组蛋白亚单位疫苗中掺入合适的佐剂以减少疫苗接种次数和抗原剂量,并有效诱导中和抗体和细胞免疫应答,是阻止新冠疫情大流行的潜在策略之一。
近年来,国家纳米科学中心陈春英课题组在重组蛋白亚单位疫苗、核酸疫苗等的精准组装及高效递送方面开展了一系列研究(Nano Lett. 2012, 12 (4), 2003-2012; Adv. Mater. 2013, 25 (41), 5928-5936)。同时,基于同步辐射等大科学装置,建立与发展了具有高灵敏、高分辨、元素特异、原位等优点的复杂生物体系中纳米材料的分析方法。这些原位、无损分析方法对于认识纳米佐剂在抗原递呈细胞内的行为,清晰阐释免疫调控机制,精准构筑新型疫苗纳米佐剂具有重要指导意义。
在前期工作的基础上,近日,陈春英课题组与中国医学科学院医学生物学研究所刘野课题组合作在Nano Today杂志在线发表了题为“Engineering a self-navigated MnARK nanovaccine for inducing potent protective immunity against novel coronavirus”的保护性疫苗的最新研究成果,报道了一种淋巴结自导航的新型锰纳米佐剂新冠病毒重组亚单位疫苗。
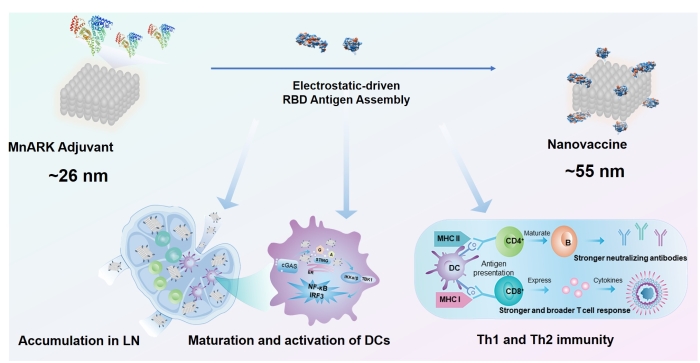
本研究提出了集蛋白原位佐剂矿化与抗原共递送、多尺度疫苗追踪以及免疫效应机理的组学分析在内的“三位一体”纳米疫苗研究策略。白蛋白作为血液和组织间质液中最普遍存在的蛋白质,其形成的蛋白冠不仅是影响纳米材料体内转运、代谢和生物利用的重要因素(Nat. Nanotechnol. 2021, DOI:10.1038/s41565-021-00856-w; Acc. Chem. Res. 2019, 52 (6), 1507-1518),也是铝佐剂疫苗接种后与抗原竞争占位、影响抗原稳定性及疫苗保护效力的关键因素之一。同时,白蛋白作为淋巴结自靶向的抗原伴侣蛋白及良好的生物矿化模板,是抗原佐剂共递送系统的绝佳选择。基于此,该研究以白蛋白为模板原位矿化制备锰纳米佐剂,通过静电作用驱动与新冠S蛋白受体结合结构域(RBD)自组装形成新型纳米疫苗。
为探索疫苗产生保护效力的过程,该研究建立了多尺度疫苗追踪技术,首次结合同步辐射硬X射线纳米CT技术实现了锰纳米佐剂在树突状细胞(DC细胞)的三维定位成像,阐明了体内疫苗的淋巴结靶向及抗原递呈细胞(APC)摄入行为;有效利用白蛋白的自导航淋巴结能力及适宜淋巴引流的尺寸,将RBD抗原与锰纳米佐剂同时高效递送至淋巴结,并促进抗原递呈细胞摄入,刺激细胞和体液免疫双重响应。与锰离子疫苗相比,基于该策略构筑的新型纳米疫苗安全性、免疫刺激能力均有显著提升。更为重要的是,研究发现,即使降低5倍抗原剂量也可产生优于传统铝佐剂疫苗的新冠病毒中和能力,并能刺激记忆T细胞产生,具备长效持久抵抗病毒入侵的潜力。
国家纳米科学中心项目研究员王亚玲、特别研究助理郭梦雨和中国医学科学院医学生物学研究所研究助理解裕萍、博士生研究生罗佳为该文章的共同第一作者,陈春英研究员、刘野研究员为通讯作者。上述研究工作得到了政府间国际科技创新合作重点专项、国家重点研发计划、国家自然科学基金、中科院战略性先导科技专项(B类)、中国医学科学院创新工程以及北京同步辐射光源等的支持。
设计抗原/ MnARK佐剂共递送纳米疫苗对抗新冠病毒示意图