



近日,国家纳米科学中心王海研究员和聂广军研究员团队合作在RNA疫苗对于肿瘤的免疫治疗方面取得新进展。相关研究成果“In Situ Transforming RNA Nanovaccines from Polyethylenimine Functionalized Graphene Oxide Hydrogel for Durable Cancer Immunotherapy”发表于Nano Letters。
肿瘤mRNA疫苗是将mRNA通过免疫细胞的翻译系统合成相应的肿瘤抗原蛋白,进而诱导人体产生对该抗原蛋白的免疫应答,激活细胞免疫和体液免疫,达到对肿瘤细胞的杀伤效果。然而,RNA单独暴露于体内环境中非常容易被降解,并且mRNA无法自行进入细胞内部,更无法实现持久性治疗效果。同时,肿瘤微环境中的免疫抑制性还会使杀伤性T细胞功能受到干扰,需要通过其他手段进一步刺激和扩大抗原特异性T细胞的功能。因此,开发有效的RNA疫苗和免疫佐剂递送体系,保护RNA疫苗免于降解,通过单次注射实现长久稳定免疫对于个体化肿瘤疫苗的开发具有重要意义。
为了克服这些问题,研究团队设计了一种含有氧化石墨烯和低分子量聚乙烯亚胺的非化学键连接水凝胶。该凝胶可以通过正负电荷吸附和π-π共轭有效负载mRNA疫苗和疏水性免疫佐剂(R848),并保护RNA疫苗不被外界各种酶降解。区别于传统的化学交联水凝胶,新型水凝胶由于通过电荷吸附组装,在液体环境中其表面处于不稳定状态,可以逐渐变形为纳米疫苗并靶向免疫系统(图1)。体内动物实验显示将其皮下注射后,可以至少在30天内持续释放RNA纳米疫苗,进入引流淋巴结内部并且被抗原提呈细胞摄取,实现持久的抗肿瘤免疫治疗效果。该方法为RNA疫苗稳定保存和递送提供了新的解决方案,文章发表后获得大量关注,美国化学学会对该工作进行专门的采访和报道。
国家纳米科学中心特别研究助理印悦博士为该论文的第一作者,王海研究员和聂广军研究员为通讯作者。这项工作得到了科技部重点研发计划、国家自然科学基金、中国科学院前沿科学重点研究计划等项目的支持。
原文链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.0c05039。
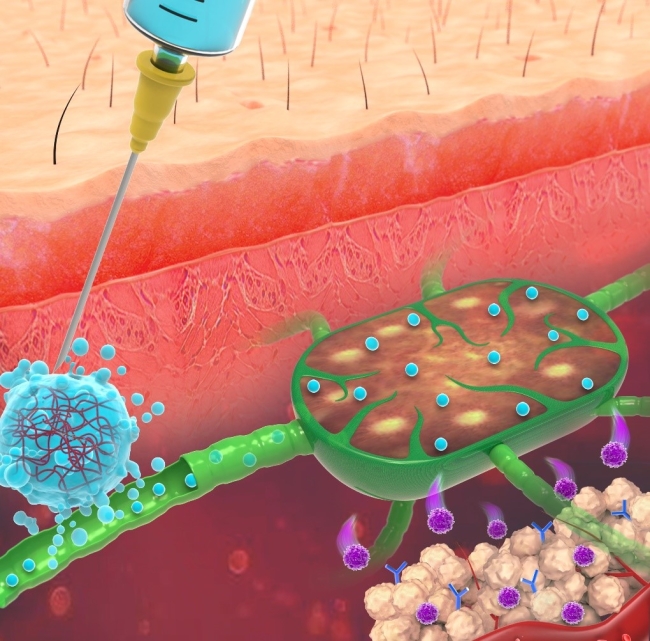
图 1.可转换为纳米疫苗的水凝胶长效稳定RNA疫苗的作用机理图